Traducción
Andres D. Sanabria-Velazquez1, Tika Adhikari1 and Frank Louws1,2
1Department of Entomology and Plant Pathology, North Carolina State University, 1575 Varsity Drive, VRB Module 6, Raleigh, NC 27695
E-mail: adsanabr@ncsu.edu ↲ and tbadhika@ncsu.edu ↲
2Department of Horticultural Science, North Carolina State University, 118 Kilgore Hall Raleigh, NC, 27695-7609.
E-mail: fjlouws@ncsu.edu ↲
Introducción
La antracnosis es una enfermedad importante de la fruta de fresa, coronas, hojas, pecíolos y estolones. Tres especies relacionadas del hongo Colletotrichum, incluyendo C. acutatum, C. gloeosporioides y C. fragariae pueden asociarse con plantas de fresa. Esta hoja informativa destaca la antracnosis de la corona (ACR) causada principalmente por C. gloeosporioides y ocasionalmente por C. fragariae (algunos los clasifican dentro del mismo grupo de especies; otros los consideran especies diferentes). El control de enfermedades es difícil cuando las condiciones ambientales son favorables, y la enfermedad puede ser especialmente destructiva para los cultivares de fresa de California cuando se cultiva en plástico negro. El patógeno tiende a estar asociado con la fase de pudrición de la corona de la antracnosis, pero también puede afectar a otras partes de la planta.
Síntomas y signos
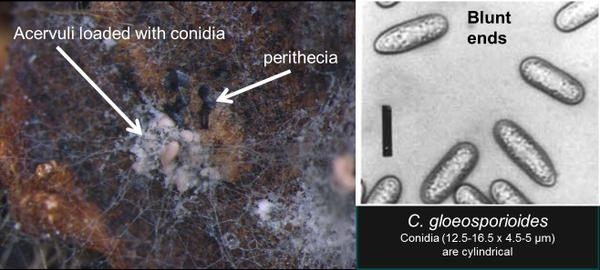
El síntoma más diagnóstico de ACR es el estriado rojo y blanco de la corona (Figura SS-1). Sin embargo, los síntomas iniciales de ACR incluyen retraso en el crecimiento de las plantas y marchitamiento de las hojas jóvenes debido a la falta de agua (Figura SS-2). Inicialmente, las plantas se marchitan en el calor del día, que a menudo se pasa por alto como sequía o estrés por calor. En casos de infección avanzada, toda la planta muere (Figura SS-2). Cortar la corona a lo largo revela rayas blancas y marrones rojizas, creando un efecto jaspeado o una podredumbre firme (Figura SS-1). En algunos casos, ACR puede causar síntomas foliares que aparecen como manchas negras circulares en la superficie superior de las hojas jóvenes y mediana edad (Figura SS-3). El patógeno también puede transmitirse con los estolones y causar daños en las instalaciones de producción de trasplantes (Figura SS-3). Los trasplantes primero aparecerán atrofiados, mostrarán signos de marchitamiento comenzando con la hoja más joven y luego colapsarán por completo. Las coronas pequeñas a menudo se vuelven jaspeadas o completamente marrones y estolones infectados tienen un sistema radicular deficiente o nulo, lo que resulta en un colapso generalizado cuando disminuye la humedad (Figura SS-3). Las raíces en el sitio de unión a la corona tienden a permanecer blancas y todo el sistema radicular tiende a permanecer fibroso. Esto en contraste con la podredumbre de la corona de Phytophthora, donde la lesión en la corona generalmente tiene una decoloración consistente de color rojo oscuro a marrón, aunque puede ser estriada, y las raíces en el sitio de unión son típicamente negras y tienen una estructura fibrosa pobre. Además, el tejido infectado asociado con ACR, como los pecíolos o las coronas jaspeadas colocadas en una cámara de incubación, especularán dentro de las 24 horas y los acervulos combinados con el tipo de espora son diagnósticos; ocasionalmente puede haber peritecios (Figura SS-4). Para diferenciar ACR de Phytophthora se puede usar la clave de diagnóstico en la Figura SS-5.

Figura SS-2: Rango de síntomas de antracnosis de la corona que muestra plantas con síntomas tempranos de marchitamiento de las hojas (arriba a la izquierda); plantas atrofiadas que muestran marchitez (arriba a la derecha); Plantas completamente colapsadas (fila inferior) y decoloración de la corona (abajo a la derecha)

Figura SS-3: Hoja joven que muestra mancha foliar negra circular debido a infección por C. gloeosporioides; una instalación de producción de plantines con una alta incidencia de antracnosis de la corona aproximadamente 3 semanas después del trasplante; podredumbre inferior del pecíolo; estriado interno de la corona y podredumbre inferior del pecíolo.
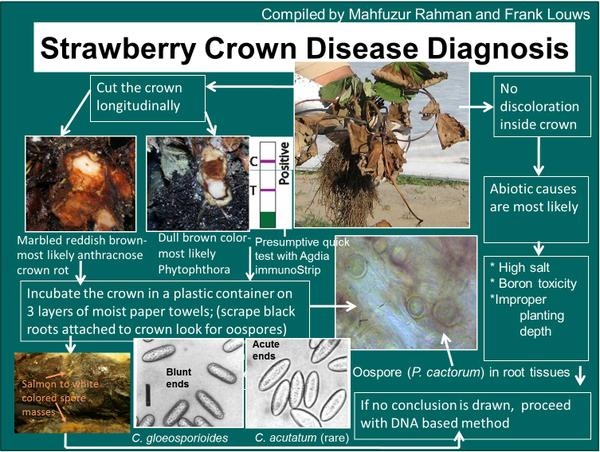
Figura SS-5: Una clave de diagnóstico para Carolina del Norte para discernir si el marchitamiento de la planta antracnosis de la corona en comparación a Phytophthora o un problema abiótico. Los kits de serología están disponibles en Agdia; además de las herramientas moleculares pueden ser necesarias para un diagnóstico del 100% en algunos casos.
Ciclo de la enfermedad
Los trasplantes infectados son la principal fuente de inóculo en los campos de fresas. El patógeno puede estar presente en lesiones activas, pero en la mayoría de los casos se encuentra en una fase quiescente, es decir, ha infectado el tejido verde pero no está causando síntomas. Esta fase sin síntomas del ciclo de la enfermedad permite que el patógeno se acumule sin ser detectado y luego la expresión de la enfermedad ocurre en condiciones climáticas favorables (por ejemplo, húmedo y caliente) o cuando hay algún tipo de cambios químicos / fisiológicos en la planta. En viveros (más en Piedmont y las regiones de producción al Este; menos en las montañas al Oeste) y, a veces, en campos frutales, el patógeno puede originarse en especies de plantas no cultivadas, comenzar en la fase quiescente, pero pasar rápidamente a la fase necrótica o sintomática. En Carolina del Norte, las plantas importantes incluyen la enredadera de Virginia (Parthenocissus quinquefolia), la uva silvestre y muscadina (Vitis / Muscadinia rotundifolia) y cozolmecatl (Smilax rotundifolia). Otros huéspedes potenciales no cultivados identificados en Florida incluyen papa voladora (Dioscorea bulbifera), magnolia (Magnolia virginiana L.), mirto de cera (Myrica cerifera L.), roble (Quercus spp.), perejil brasileño (Richardia brasiliensi) y malva blanca (Urena lobata). Sin embargo, esta especie patógena es compleja y solo alrededor del 10 al 67% de los aislados de C. gloeosporioides de estas malezas son patógenos en la fresa.
Una vez que comienza la enfermedad, las esporas de conidios se producen en abundancia en pecíolos, estolones y tejido de la corona superior. Los conidios se dispersan a través de salpicaduras de lluvia, especialmente lluvia dispersada por el viento. El movimiento de maquinaria y trabajadores a través del campo también puede contribuir a la propagación del inóculo. Las condiciones cálidas y húmedas son óptimas para esta enfermedad, por lo que se deben utilizar prácticas culturales que fomenten la aireación y el secado rápido de las plantas. Los mantillos de paja pueden ayudar a reducir la dispersión de esporas en salpicaduras de agua, pero los acolchados de plástico proporcionan un trampolín para las gotas, fomentando así la propagación de enfermedades. El riego por encima de la cabeza también puede contribuir a la propagación de enfermedades.
Manejo de la enfermedad
El manejo de la Antracnosis de la corona en una instalación de producción de plantines requiere un enfoque único y no se discute aquí. La información está disponible bajo petición.
Cultural
- Uso de plantas libres de enfermedades
Rara vez la Antracnosis de la corona se repite año tras año en la misma parcela, porque la enfermedad se ha asociado con plantas asintomáticas importadas de viveros de suministros de trasplante. Por lo tanto, el uso de plantas libres de enfermedades es la estrategia de manejo más importante para controlar esta enfermedad, pero los viveros generalmente no son conscientes de que existe un problema. Aunque existen métodos de detección rápida para detectar el patógeno, no existe un protocolo de muestreo aceptado para asegurar que un proveedor de plantas esté libre de enfermedades. Plantas resistentes no están disponibles.
- Rotación de cultivos y manejo de plantas no cultivadas
La rotación de fresas durante 2 o 3 años ayudará a eliminar el inóculo del campo de los tejidos vegetales infectados o los desechos infestados en el suelo. Sin embargo, la Antracnosis de la corona no reaparece comúnmente un segundo año en un campo a menos que la enfermedad se vuelva a introducir en plantas contaminadas. Si la enfermedad se repite en varios años, es probable que la fuente sean las plantas locales que pueden albergar el patógeno. Estas plantas no cultivadas deben eliminarse con énfasis en las especies identificadas anteriormente.
- Monitoreo de la enfermedad
El monitoreo periódico de un campo, especialmente durante el clima cálido y húmedo, permitirá la detección temprana de la antracnosis. Tan pronto como se descubra la enfermedad, elimine y destruya inmediatamente las plantas infectadas y circundantes para ayudar a reducir los niveles de inóculo. Matar las plantas con herbicida iniciará la producción de esporas por el patógeno, y si estas plantas no se eliminan, el problema se agravará. En la mayoría de los casos, las plantas infectadas mueren dentro de los 30 a 45 días posteriores al trasplante con una segunda aparición de muerte de la planta a fines de la primavera. Sin embargo, la cantidad de plantas muertas es limitada en los sistemas de producción de frutas, a diferencia de la antracnosis de la fruta que puede dañar todo un cultivo.
Los niveles de nitrógeno deben mantenerse en el nivel óptimo, ya que los altos niveles de nitrógeno en el suelo favorecen el desarrollo de hongos. Mantenga el follaje seco y reduzca las salpicaduras de agua mediante el uso de riego por goteo para ayudar a reducir la dispersión conidial y la propagación del patógeno.
Control químico
Las recomendaciones actuales de fungicidas están disponibles en la Guía de IPM de Fresa. Si las plantas de raíz desnuda están infectadas y no hay una fuente alternativa de plantas disponibles, las inmersiones de plantas enteras en el fungicida Switch® (Cyprodinil + Fludioxonil) son muy útiles, reduciendo la muerte de la planta hasta en 1⁄3 o más. Las tasas se proporcionan en la guía Guía de IPM de Fresa y las plantas deben establecerse en campo lo antes posible después del tratamiento para evitar problemas de retraso en el crecimiento de las plantas. Una o dos pulverizaciones foliares dirigidas hacia la corona en el otoño cuando se pronostica un clima cálido y húmedo pueden reducir la propagación de la enfermedad. Una estrategia similar a principios y mediados de la primavera es útil. Los productos, las tasas y las estrategias de gestión resistentes se describen en la Guía de IPM de Fresa.
Patógeno
Colletotrichum gloeosporioides, y C. Las fragarias son hongos necrótrofos anamórficos que causan la pudrición de la corona de antracnosis en la fresa. Ambas especies producen síntomas similares en la fresa y se distinguen tradicionalmente por la morfología conidial, la presencia o ausencia de setos, la presencia de un estado teleomorfo y el color de la colonia (Gunnell y Gubler, 1992).
Colletotrichum gloeosporioides (Penz.) Penz. y Sacc. tiende a asociarse con la fase de pudrición de la antracnosis de la corona, pero también puede causar pudrición de la fruta. Con frecuencia se ha aislado en viveros. Esta especie comúnmente forma peritecios del estado teleomorfo, G. cingulata. Las masas conidiales son de color rosa pálido, blanquecinas o translúcidas. Los conidios producidos por C. gloeosporioides son cilíndricos, redondeados en la base, y miden de 14.5 a 17 x 4 a 4.5 μm. Los conidios también son aseptados, de paredes delgadas e hialinos. Esta especie produce 1-3 setas tabicadas que miden de 70 a 103 x 3.5 a 4.5 μm. En agar dextrosa de patata (PDA), colonias de C. gloeosporioides tienen un crecimiento micelial denso y blanco que se vuelve de un color gris oliva oscuro con la edad (Gunnell y Gubler, 1992; Smith, 1998).
Colletotrichum fragariae A. N. Brooks se asocia principalmente con la podredumbre de la corona y no es comúnmente un problema en la fruta. No se ha aislado como un patógeno común en Carolina del Norte desde 1986. Las lesiones se forman en pecíolos, estolones y hojas. Los conidios (12.5-16.5 x 4.5-5 μm) son cilíndricos, rectos y redondeados en el ápice y se estrechan hasta un punto en la base. Se producen en acervulos o en hifas aéreas. Las setas (80-200 x 3-4.5 μm) suelen estar presentes y son 3-5 septadas y fasciculadas. En PDA, las colonias son de color oliva, gris o negro con reverso gris oscuro u oliva. C. fragariae no tiene un estado teleomorfo conocido (Gunnell y Gubler, 1992; Smith, 1998).
Procedimientos de diagnóstico
Una de las primeras indicaciones de la antracnosis de la corona en las plantas de fresa es el desarrollo de síntomas de sequía solo en el follaje que se origina en una sola corona. Las plantas con antracnosis de la corona también tienen sistemas de raíces bien desarrollados, en contraste con los sistemas de raíces podridas y débiles de las plantas con podredumbre de la corona de Phytophthora o podredumbre de la raíz negra. Un síntoma revelador de infección por C. fragariae o C. gloeosporioides se puede encontrar cuando la corona se abre longitudinalmente; un estriado con distintas áreas rojas y blancas y su interfaz está presente.
Si se sospecha que las coronas de fresa tienen antracnosis de la corona pero no hay signos evidentes del patógeno, se puede inducir la esporulación colocando las coronas de fresas en una cámara húmeda durante 24 a 48 horas.
Tradicionalmente, las características morfológicas como la forma conidial, la presencia o ausencia de setas y el color de la colonia se han utilizado para diferenciar las especies de Colletotrichum. Estos rasgos, sin embargo, son muy variables entre los aislados y a menudo están sujetos a interpretación. Las diferencias morfológicas entre C. fragariae y C. gloeosporioides son demasiado sutiles para una diferenciación confiable cuando se cultivan en PDA. Para realizar mediciones y observaciones morfológicas de conidios y setas, los aislados deben cultivarse en agar hoja de fresa (SLA) bajo luz fluorescente continua.
Los análisis de secuencia de ITS son la forma más fiable de identificar especies de Colletotrichum. Las regiones espaciadoras transcritas internas, incluido el ADNr 5.8, se pueden amplificar utilizando cebadores universales ITS1 e ITS4 como parte de un protocolo de PCR estándar (Garrido et al., 2009).
Referencias
Garrido C., Carbú, M., Fernández-Acero, F. J., Vallejo, I., Cantoral, J. M. 2009. Relaciones filogenéticas y organización genómica del Colletotrichum acutatum causante de antracnosis en fresa. European Journal of Plant Pathology 125: 397–411. ↲
Gunnell, P. S., y Gubler, W. D. 1992. Taxonomía y morfología de especies de Colletotrichum patógenas para la fresa. Mycologia 84:157–165. ↲
Smith, B. J. 1998. Podredumbre de la corona de antracnosis. Pp. 46-48 en: Compendium of Strawberry Diseases, 2nd edition, Maas, J. L. (ed.). APS Press. St. Paul, MN. ↲
Publication date: Jan. 5, 2024
There is an alternate English language version of this document here: Anthracnose Crown Rot of Strawberry
Recommendations for the use of agricultural chemicals are included in this publication as a convenience to the reader. The use of brand names and any mention or listing of commercial products or services in this publication does not imply endorsement by NC State University or N.C. A&T State University nor discrimination against similar products or services not mentioned. Individuals who use agricultural chemicals are responsible for ensuring that the intended use complies with current regulations and conforms to the product label. Be sure to obtain current information about usage regulations and examine a current product label before applying any chemical. For assistance, contact your local N.C. Cooperative Extension county center.
N.C. Cooperative Extension prohibits discrimination and harassment regardless of age, color, disability, family and marital status, gender identity, national origin, political beliefs, race, religion, sex (including pregnancy), sexual orientation and veteran status.