Introducción
La interferencia de malezas puede provocar grandes pérdidas en el rendimiento del camote (Seem et al. 2003; Meyers et al. 2010; Meyers and Shankle 2016). El amaranto Palmer (Amaranthus palmeri) es la maleza más problemática y más frecuente en el cultivo de camote en Carolina del Norte, y le sigue el coquillo amarillo (Cyperus esculentus) (Webster 2010). Es una maleza agresiva que compite en gran medida con el maní, la soja, el algodón y el camote (Burke et al. 2007; Chandi et al. 2012; Meyers et al. 2010; Morgan et al. 2001; Smith et al. 2020). La mayoría de las poblaciones de amaranto Palmer en Carolina del Norte son resistentes al glifosato y a la acetolactato sintasa (ALS), inhibiendo los herbicidas. Ahora se ha demostrado que algunas poblaciones de amaranto Palmer también son resistentes a los herbicidas inhibidores de la protoporfirinógeno oxidasa (PPO).
Características de Identificación
El amaranto Palmer a menudo se confunde con otras especies de amaranto, incluido el amaranto de raíz roja, el amaranto espinoso, el amaranto liso (también llamado verde) y el amaranto delgado. De estos cinco, el amaranto Palmer es la única especie con plantas macho y hembra. El amaranto Palmer se puede distinguir porque no tiene una espina en la base del pecíolo, no tiene pelos en las superficies del tallo y las hojas, y presenta un pecíolo que es tan largo o más largo que su hoja (Weakley 2015). Una manera fácil de determinar la longitud del pecíolo es arrancar una hoja y un pecíolo de la planta y doblar el pecíolo hacia atrás sobre la lámina foliar para comparar las longitudes del pecíolo y de la lámina foliar. Los pecíolos largos son más evidentes en las hojas más viejas de la planta que están presentes en la parte inferior del tallo. El amaranto delgado y el amaranto Palmer son particularmente difíciles de distinguir. El amaranto delgado rara vez crece más de 3 pies y su infrutescencia es marrón; el amaranto Palmer puede crecer más de 7 pies y su infrutescencia es verde. La panícula apical del amaranto Palmer hembra presenta una infrutescencia apical principal que puede medir hasta 3 pies de largo. La infrutescencia también tiene brácteas rígidas y afiladas que hacen que las vuelve espinosas al tacto.
Reproducción y Hábitos de Crecimiento del Amaranto Palmer
El amaranto Palmer es una maleza anual (Franssen et al. 2001) originaria del norte de México y el suroeste de los Estados Unidos (Ward et al. 2013). Puede tolerar altas temperaturas mejor que muchos cultivos, con tasas de crecimiento más altas entre 97 ºF y 115 ºF (Ehleringer 1983). El amaranto Palmer crece rápidamente, a un ritmo de 2.5 pulgadas por día (Smith et al. 2020). Como crece y se asienta rápidamente puede competir con el cultivo de producción por el agua, los nutrientes y la luz. Cada planta hembra puede producir entre 200,000 y 600,000 semillas por planta, dependiendo del momento de emergencia (Keeley et al. 1987). El amaranto Palmer es muy oportunista: con temperatura y humedad óptimas, el 100 % de las semillas viables germinarán el primer día de siembra (Steckel et al. 2004). El amaranto Palmer crece más rápido y acumula más materia seca que otras especies Amaranthus, incluido el amaranto de raíz roja (Sellers et al. 2003).
Impactos del Amaranto Palmer en la Producción y la Calidad del Camote
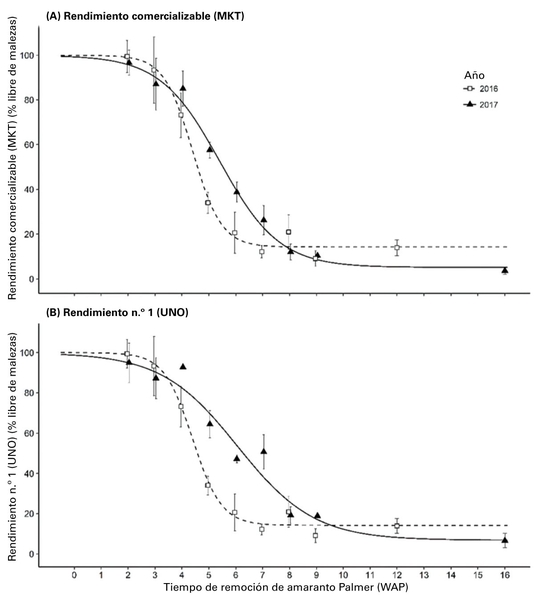
En investigaciones previas, Meyers et al. (2010) demostraron que el amaranto Palmer puede disminuir la producción comercializable del camote hasta en un 81 %. Incluso a bajas densidades de una sola planta de amaranto Palmer por cada 3 pies de hilera de camote, la pérdida de rendimiento puede ser tan alta como el 52 %. La producción comercializable (n.º 1+ de gran tamaño) disminuyó 6 % y 27 %, respectivamente, cuando se permitió que el amaranto Palmer germinara después del trasplante de camote y luego se retiró a las tres y cuatro semanas después del trasplante (Figura 1). La interferencia del amaranto Palmer durante toda la temporada resultó en una pérdida de la producción del 91 % (Smith et al. 2020).
El amaranto Palmer que se retiró a las dos semanas después del trasplante disminuyó la producción n.º 1 en un 5 % y el rendimiento comercializable en un 4 % (Figura 1).
A las tres semanas después del trasplante, el amaranto Palmer puede medir aproximadamente 5 pulgadas de alto; la eliminación en este momento puede provocar una disminución del 13 % en la producción comercializable (Figura 2). La eliminación del amaranto Palmer más allá de las tres semanas después del trasplante puede provocar una disminución del 97 % en la producción.
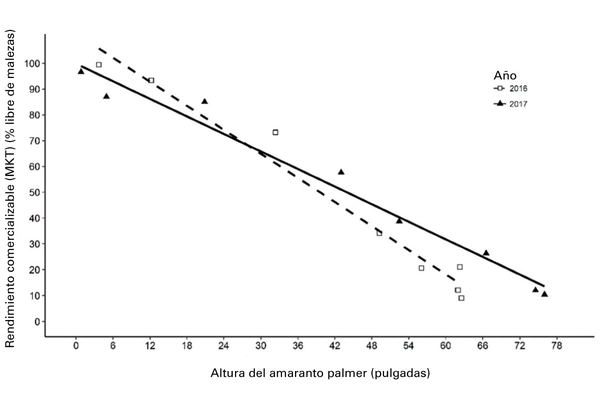
Existe una sólida correlación entre la altura del amaranto Palmer y la producción comercializable del camote. Por cada pulgada de crecimiento de amaranto Palmer, la producción comercializable puede disminuir en un 1.25 %. Se observó una disminución del 5 % en la producción cuando el amaranto Palmer alcanzó una altura de 10.5 y 4.25 pulgadas en 2016 y 2017, respectivamente (Figura 3).
Suponiendo un umbral aceptable de pérdida de la producción comercializable del 5 %, el momento crítico para la eliminación del amaranto Palmer en el cultivo de camote es dos semanas después del trasplante. Por lo tanto, la exploración a inicios de la temporada y la eliminación incipiente del amaranto Palmer en los campos de camote son fundamentales. Cualquier retraso en la eliminación puede provocar disminuciones sustanciales de la producción y menos raíces de primera calidad.

Figura 2. El amaranto Palmer interfiere con el cultivo de camote a las tres semanas después del trasplante en Clinton, Carolina del Norte, en 2017. La primera hilera (la hilera con estacas) es una hilera de borde libre de malezas, mientras que la segunda es una hilera de tratamiento con amaranto Palmer que crece sobre las plantas de camote.
Control del Amaranto Palmer en el Cultivo de Camote
El amaranto Palmer emerge de marzo a octubre en Carolina del Norte y puede germinar, crecer y producir semillas en unos 30 días. Comience con un lecho de siembra limpio. Todas las plantas deben ser controladas antes de la producción de semillas.
Las opciones de herbicidas para el control del amaranto Palmer en el cultivo de camote son limitadas. Los únicos herbicidas registrados para su aplicación en el cultivo de camote y que tienen actividad sobre el amaranto Palmer son la flumioxazina (Valor), el fomesafen (Reflex) y el S-metolacloro (Dual Magnum). La flumioxazina, el fomesafen y el
S-metolacloro solo tienen actividad previa a la emergencia en el amaranto Palmer; una vez que el amaranto Palmer ha emergido, el S-metolacloro y la flumioxazina no lo controlan. La flumioxazina y el fomesafen deben aplicarse al lecho preformado antes de trasplantar los brotes de camote. El fomesafen no debe aplicarse junto con la flumioxazina. En su lugar, los productores deben elegir uno u otro en función de las malezas previstas y los cultivos futuros. Existen posibles problemas de arrastre (carryover) con el fomesafen, por lo que se debe leer las etiquetas de los herbicidas detenidamente antes de su uso. El camote debe trasplantarse a lechos libres de malezas. Por lo tanto, puede ser necesario volver a trabajar los lechos antes de trasplantar el camote. Es mucho más difícil controlar el amaranto Palmer después de haber plantado el camote y después de que haya emergido el amaranto Palmer. El S-metolacloro debe aplicarse al camote libre de malezas después de un evento de cultivo y/o de eliminación manual de la maleza de 7 a 14 días después del trasplante para reducir el riesgo de dañar las raíces de almacenamiento del camote en desarrollo. Si el S-metolacloro se aplica demasiado pronto después del trasplante y se producen fuertes lluvias, pueden producirse daños, como el acortamiento y el redondeo de las raíces (Blankenship et al. 2024; Meyers et al. 2010; Meyers et al. 2013).
Otros métodos para controlar el amaranto Palmer en el cultivo de camote incluyen el cultivo, la remoción manual y la siega. El equipo de cultivo estándar puede ser eficaz para eliminar el amaranto Palmer pequeño (<2 pulgadas) en las hileras y entre ellas si el cultivo es oportuno (K.M. Jennings, comunicación personal). La remoción manual del amaranto Palmer es posible, pero muy costosa (de 200 USD a 400 USD por acre) en comparación con otros métodos de control de malezas (Ted Burch, productor, comunicación personal en una conversación telefónica el 13 de noviembre de 2018). Puede ser difícil remover manualmente el amaranto Palmer una vez que alcanza aproximadamente las 18 pulgadas de alto porque el tallo se vuelve leñoso y forma una raíz principal profunda y una red de raíces fibrosas. Puede ser necesario usar un machete para cortar el tallo en la superficie del suelo si no se puede tirar de la planta con la mano. Las plantas que se extraen deben retirarse del campo y compostarse o quemarse. Las plantas que quedan en la superficie del suelo volverán a enraizar y continuarán creciendo y produciendo semillas viables. Los tallos cortados de tan solo 1 pulgada pueden volver a brotar, florecer y producir semillas (Sosnoskie et al. 2014).
Interceptar la luz es uno de los principales mecanismos de competencia del amaranto Palmer en el cultivo de camote (Moore et al. 2021). Si las plantas de amaranto Palmer evaden el control y crecen por encima de la canopia del camote, puede ser beneficioso usar una cortadora para controlar la parte de la maleza que está por encima de la canopia del cultivo. Corte el amaranto Palmer antes de que la semilla madure para evitar que la semilla se esparsa por la superficie del suelo, donde puede germinar en la misma temporada o en los próximos años. Después de la siega, el amaranto adopta un patrón de crecimiento horizontal. Aunque seguirá compitiendo con el cultivo por el agua y los nutrientes, ya no dará sombra al cultivo y, si se corta en el momento adecuado, producirá menos semillas.
Debido a que las semillas del amaranto Palmer son tan pequeñas, se puede realizar una labranza profunda antes de preparar el lecho para enterrar las semillas y evitar su emergencia. La labranza profunda por sí sola puede reducir la emergencia del amaranto Palmer en la siguiente temporada de cultivo en un 81 % (DeVore 2012). Después de tres años del entierro a una profundidad de 4 pulgadas, solo el 15 % de las semillas de amaranto Palmer seguirán siendo viables (Sosnoskie et al. 2012). La labranza profunda no debe realizarse todos los años porque las semillas volverán a la superficie del suelo.
Referencias
Blankenship, C. D., K. M. Jennings, D. W. Monks, S. L. Meyers, D. L. Jordan, J. R. Schultheis, D. H. Suchoff, L. D. Moore, S. J. Ippolito. 2024. “Effect of S-metolachlor and flumioxazin herbicides on sweetpotato treated with and without activated charcoal applied through transplant water.” Weed Technology 38, e50. doi:10.1017/wet.2024.48 ↲
Burke, I. C., M. Schroeder, W. E. Thomas, and J. W. Wilcut. 2007. “Palmer amaranth interference and seed production in peanut.” Weed Technology 21(2): 367–371. ↲
Chandi, A., D. L. Jordan, A. C. York, S. R. Milla-Lewis, and J. D. Burton. 2012. “Interference of selected Palmer amaranth (Amaranthus palmeri) biotypes in soybean (Glycine max).” International Journal of Agronomy. ↲
DeVore, J. D., J. K. Norsworthy, and K. R. Brye. 2012. “Influence of deep tillage and a rye cover crop on glyphosate-resistant Palmer amaranth (Amaranthus palmeri) emergence in cotton.” Weed Technology 26 (4): 832–838. ↲
Ehleringer, J. 1983. “Ecophysiology of Amaranthus palmeri, a Sonoran Desert summer annual.” Oecologia 57:107–112. ↲
Franssen, A. S., D. Z. Skinner, K. Al-Khatib, M. J. Horak, and P. A. Kulakow. 2001. “Interspecific hybridization and gene flow of ALS resistance in Amaranthus species.” Weed Science 49 (5): 598–606. ↲
Meyers, S. L, K. M. Jennings, J. R. Schultheis, and D. W. Monks. 2010. “Interference of Palmer amaranth (Amaranthus palmeri) in sweetpotato.” Weed Science 58 (3):199–203. ↲
Meyers, S. L., K. M. Jennings, D. W. Monks, D. K. Miller, and M. W. Shankle. 2013. “Rate and application timing effects on tolerance of Covington sweetpotato to S-metolachlor.” Weed Technology 27 (4): 729–734. ↲
Meyers, S. L. and M. W. Shankle. 2016. “Postemergence yellow nutsedge management in sweetpotato.” Weed Technology 30 (1): 148–153. ↲
Moore L. D., K. M. Jennings, D. W. Monks, D. L. Jordan, R. G. Leon, M. D. Boyette. 2021. “Evaluating shade cloth to simulate Palmer amaranth (Amaranthus palmeri) competition in sweetpotato.” Weed Science 69 (4):478–484. doi:10.1017/wsc.2021.21 ↲
Morgan, G. D., P. A. Baumann, and J. M. Chandler. 2001. “Competitive impact of Palmer amaranth (Amaranthus palmeri) on cotton (Gossypium hirsutum) development and yield.” Weed Technology 15 (3):: 408–412. ↲
Seem, J. E., N. G. Creamer, and D. W. Monks. 2003. “Critical weed-free period for 'Beauregard' sweetpotato (Ipomoea batatas).” Weed Technology 17 (4): 686–695. ↲
Sellers, B. A, R. J. Smeda, W. G. Johnson, J. A. Kendig, and M. R. Ellersieck. 2003. “Comparative growth of six Amaranthus species in Missouri.” Weed Science 51 (3): 329–333. ↲
Smith, S. C., K. M. Jennings, D. W. Monks, S. Chaudhari, J. R .Schultheis, S. C. Reberg-Horton. 2020. Critical timing of Palmer amaranth (Amaranthus palmeri) removal in sweetpotato. Weed Technology 34:547–551 ↲
Sosnoskie, L. M., T. M. Webster, A. S. Culpepper, and J. Kichler. 2014. The Biology and Ecology of Palmer Amaranth: Implications for Control. Circular 1000. University of Georgia Extension. ↲
Sosnoskie, L. M., T. M. Webster, and A. S. Culpepper. 2012. “Glyphosate resistance does not affect Palmer amaranth (Amaranthus palmeri) seedbank longevity.” Weed Science 61 (2): 283–288. ↲
Steckel, L. E., C. L. Sprague, E. W. Stoller, and L. M. Wax. 2004. “Temperature effects on germination of nine Amaranthus species.” Weed Science 52 (2): 217–221. ↲
Ward, S. M., T. M. Webster, and L. E. Steckel. 2013. “Palmer amaranth (Amaranthus palmeri): A review.” Weed Technology 27 (1): 12–27. ↲
Weakley, A. S. 2015. Flora of the Southern and Mid-Atlantic States. University of North Carolina Herbarium, North Carolina Botanical Garden. Chapel Hill: University of North Carolina. ↲
Webster, T. M. 2010. “Weed survey-southern states: vegetable, fruit and nut crops subsection (annual weed survey).” Proceedings of the Southern Weed Science Society 63: 246–257. ↲
Publication date: Nov. 26, 2024
AG-857S
There is an alternate English language version of this document here: Management of Palmer Amaranth in Sweetpotato
Recommendations for the use of agricultural chemicals are included in this publication as a convenience to the reader. The use of brand names and any mention or listing of commercial products or services in this publication does not imply endorsement by NC State University or N.C. A&T State University nor discrimination against similar products or services not mentioned. Individuals who use agricultural chemicals are responsible for ensuring that the intended use complies with current regulations and conforms to the product label. Be sure to obtain current information about usage regulations and examine a current product label before applying any chemical. For assistance, contact your local N.C. Cooperative Extension county center.
N.C. Cooperative Extension prohibits discrimination and harassment regardless of age, color, disability, family and marital status, gender identity, national origin, political beliefs, race, religion, sex (including pregnancy), sexual orientation and veteran status.