Traducción
Andres D. Sanabria-Velazquez1, Tika Adhikari1 and Frank Louws1,2
1Department of Entomology and Plant Pathology, North Carolina State University, 1575 Varsity Drive, VRB Module 6, Raleigh, NC 27695
E-mail: adsanabr@ncsu.edu ↲ and tbadhika@ncsu.edu ↲
2Department of Horticultural Science, North Carolina State University, 118 Kilgore Hall Raleigh, NC, 27695-7609.
E-mail: fjlouws@ncsu.edu ↲
Introducción
La antracnosis es una enfermedad importante de la fresa con todas las partes de la planta (fruto, coronas, hojas, pecíolos y estolones) siendo susceptibles al patógeno. Tres especies relacionadas del hongo Colletotrichum, incluyendo C. acutatum, C. gloeosporioides y C. fragariae pueden asociarse con la antracnosis. Sin embargo, C. acutatum es el principal patógeno asociado con la fase de podredumbre de la fruta por antracnosis (AFR) y el tema principal de esta hoja informativa. El control de la enfermedad es difícil cuando las condiciones ambientales son favorables para el desarrollo de la enfermedad (ver condiciones predisponentes a continuación) y si el inóculo está presente. La enfermedad puede ser especialmente destructiva para los cultivares susceptibles de California (por ejemplo, Chandler, Camarosa, Albion) cuando se cultiva en plástico negro.
Síntomas y signos
La podredumbre de la fruta antracnosis aparece como manchas de color marrón a negro, empapadas en agua en la fruta verde y madura (Figura SS-1, Figura SS-2). Las lesiones firmes, hundidas de color marrón a negro pueden desarrollarse con el tiempo dependiendo de la humedad relativa prevalente en el momento del desarrollo de la enfermedad. Se pueden formar masas de esporas de color rosa, salmón o naranja en la lesión en condiciones húmedas (Figura SS-3, Figura SS-6) donde las lesiones pueden aparecer menos hundidas y de color marrón. En condiciones secas, las lesiones aparecen más hundidas y negras y toda la fruta puede secarse para ser momificada (Figura SS-2). Los brotes, pedicelos, pedúnculos y flores de la mayoría de los cultivares son susceptibles a C. acutatum (Figura SS-4). Las flores también pueden morir y secarse. Si la infección ocurre poco después de la polinización, la fruta en desarrollo permanece pequeña, dura y deforme. El patógeno también puede lavarse hacia abajo en la zona de la raíz y causar lesiones negras en las raíces (Figura SS-4). Las puntas de las raíces infectadas pueden provocar infecciones generalizadas en el tejido joven de los plantines (Figura SS-4) y pérdida de plantas (Figura SS-5). El tejido infectado colocado en una cámara de incubación esporulará dentro de las 24 horas. Los síntomas también pueden confundirse con la podredumbre de la fruta por Alternaria, la podredumbre de Phomopsis, la podredumbre seca de Rhizoctonia o el daño por granizo, pero la combinación de signos (esporas) y síntomas es diagnóstica para esta enfermedad.

Figura SS-5: Daño severo de las plantas durante la producción en vivero debido a Colletotrichum acutatum. Se perdieron más de 60.000 plantines de frutilla . Los síntomas a menudo aparecen primero como áreas “hundidas” de crecimiento dentro de una bandeja o a través de varias bandejas debido al retraso en el crecimiento de la planta; luego ocurre la muerte de
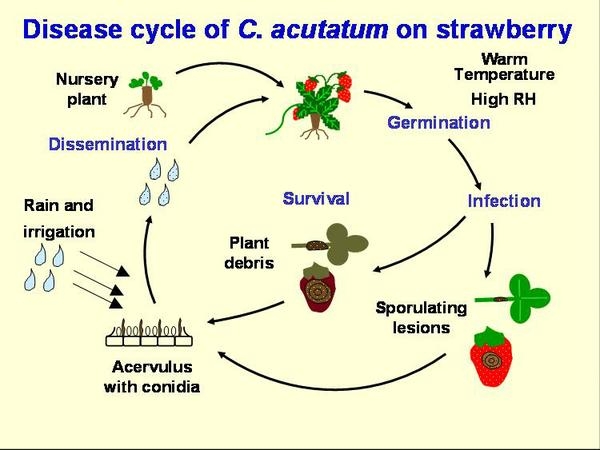
Ciclo de la enfermedad
La principal fuente de inóculo de la antracnosis ingresa a los campos en los trasplantes de fresas (Figura DC-1). El patógeno puede crecer en el tejido verde, incluso sin mostrar ningún síntoma, luego permanecer inactivo o incluso producir esporas. Cuando el tejido verde muere, el hongo se activa y puede producir muchas esporas (Figura DC-2). Se ha informado que C. acutatum sobrevive en el suelo y los restos de plantas durante nueve meses, y C. acutatum puede infectar las malezas que crecen a lo largo del campo. El patógeno puede sobrevivir en tejido vegetal vivo durante el verano. Sin embargo, en Carolina del Norte, la experiencia de campo sugiere que, durante el verano, el inóculo en suelos o malezas no es importante y los trasplantes de fresas infectados son la principal fuente de inóculo. Los pimientos con antracnosis de fruta, causados por la misma especie, también pueden representar una amenaza. En el caso del patógeno Antracnosis de la corana (ACR), la mayoría de los campos se infectan a través de trasplantes. Los conidios se producen en abundancia en pecíolos, estolones y frutas. Estos conidios se dispersan a través de salpicaduras de lluvia, especialmente lluvia impulsada por el viento. El movimiento de maquinaria y trabajadores a través del campo también puede contribuir a la propagación del inóculo. Las condiciones cálidas y húmedas son óptimas para esta enfermedad, por lo que se deben utilizar prácticas culturales que fomenten la aireación y el secado rápido de la fruta. Los mantillos de paja pueden ayudar a reducir la dispersión de esporas en salpicaduras de agua, pero los mantillos de plástico proporcionan un trampolín para las gotas, fomentando así la propagación de enfermedades. El riego por aspersión también puede contribuir a la propagación de enfermedades.
Manejo de la enfermedad
Manejo cultural
- Usa plantas libres de enfermedades
Rara vez la antracnosis se repite año tras año en el mismo campo con sistemas de producción anual. La enfermedad se ha asociado con plantas asintomáticas importadas de viveros de suministros de trasplante. La antracnosis de la corana (ACR) puede originarse a partir de especies silvestres, como se discutió anteriormente. Por lo tanto, el uso de plantas libres de enfermedades es la estrategia de manejo más importante para controlar esta enfermedad. Actualmente no existe un protocolo confiable para muestrear plantas y detectar el patógeno para declarar TODAS las plantas libres de antracnosis. Las plantas tienen un riesgo reducido de enfermedad si han sido micropropagadas y luego han entrado en un estricto programa de certificación de plantas administrado por un tercero o por la operación de vivero. Seguir pautas estrictas y bien aceptadas reduce el riesgo de antracnosis en los viveros.
- Cultivares resistentes
Los cultivares resistentes están disponibles y los esfuerzos de mejoramiento han demostrado ser prometedores. Por ejemplo, Sweet Charlie es menos susceptible a la fase de pudrición de la fruta que otros cultivares comúnmente cultivados con cobertura plástica. Una adaptación reciente de NCSU llamada ‘BISH’ tiene buena tolerancia. Obtendrá aproximadamente un 5% de resistencia a la pudrición de la fruta cuando ‘Chandler’ obtenga una incidencia del 75%. Sin embargo, ‘BISH’ no es adecuado para todas las regiones geográficas de producción.
- Monitoreo
El monitoreo periódico del campo, especialmente durante el clima cálido y húmedo, permitirá la detección temprana de la antracnosis. Si el problema parece estar asociado con puntos de alta enfermedad en el campo, retire y destruya las plantas infectadas y las plantas circundantes (radio de 5 a 10 pies). Evite matar las plantas con herbicida, puesto que iniciará la producción de esporas del patógeno, y si estas plantas no se eliminan, el problema se agravará.
Los niveles de nitrógeno deben mantenerse en el nivel requerido, ya que los altos niveles de nitrógeno en el suelo favorecen el desarrollo de hongos. Mantenga el follaje seco y reduzca las salpicaduras de agua mediante el uso de riego por goteo para ayudar a reducir la dispersión conidial y la propagación del patógeno. Use fuentes de nitrato de calcio para el nitrógeno en lugar de amonio. Las formas de nitrógeno de amonio son fácilmente accesibles para el patógeno.
- Evite el exceso de riego por aspersión (por ejemplo, para el enfriamiento por evaporación) o la utilización excesiva de fertilizante.
- Siempre recoja frutas del área infestada al final y no permita que el personal o el equipo se muevan de un área infestada a áreas limpias, para limitar la propagación del patógeno.
- No trabaje con las plantas de fresa cuando estén mojadas.
- No realice trabajos de saneamiento a principios de la primavera (quitar hojas muertas, arrancar las malas hierbas) si se sabe que C. acutatum está presente.
- Aunque sea costoso, puede ser práctico recoger y eliminar las bayas infectadas del campo para reducir la cantidad de inóculo. Sin embargo, tenga en cuenta que este patógeno coloniza las hojas y otros tejidos verdes sin mostrar síntomas. Por lo tanto, si el patógeno está en la fruta, también estará en el tejido vegetal y será imposible eliminarlo por completo. La eliminación de la fruta infectada debería ayudar a reducir la presión de la enfermedad.
- Rotación
La rotación del cultivo de fresas durante 2 o 3 años ayudará a eliminar el inóculo del campo de los tejidos vegetales infectados o los desechos infestados en el suelo. Sin embargo, en Carolina del Norte y los estados circundantes, la experiencia ha sido que la antracnosis no reaparece comúnmente un segundo año en un campo a menos que la enfermedad se reintroduzca en plantas contaminadas o si las plantas del año anterior persisten en la granja durante el verano. Por lo tanto, todas las plantas deben ser sacrificadas cuando se realiza la cosecha , especialmente si la de podredumbre de la fruta por antracnosis (AFR) estuvo presente.
Manejo químico y biológico
Los fungicidas juegan un papel importante en el manejo de esta enfermedad. Las aplicaciones de fungicidas son críticas en campos problemáticos durante la floración temprana y completa. Estos fungicidas están dirigidos a limitar la acumulación del patógeno, aunque los síntomas generalmente no son visibles. En las pruebas de investigación, los aerosoles de floración son críticos; si se sabe que la podredumbre de la fruta por antracnosis (AFR) está presente, no espere a ver los síntomas de la fruta antes de aplicar un fungicida eficaz. Si los fungicidas se aplican a partir de cuando se producen los primeros síntomas de AFR en la fruta, el control será deficiente inicialmente, ya que se necesitan de 10 a 14 días para frenar una epidemia y proteger la fruta nueva.
Los productores deben manejar los fungicidas para evitar el desarrollo de poblaciones resistentes. Un programa detallado de fungicidas está disponible en nuestra Guía regional de MIP de fresa actualizada anualmente.
Ningún agente de control biológico ha demostrado ser eficaz.
Patógeno
Las especies de Colletotrichum son hongos necrótrofos anamórficos que son capaces de infectar frutas, brotes, flores, pecíolos, estolones, coronas y follaje de plantas de fresa. La podredumbre de la fruta antracnosis es causada principalmente por Colletotrichum acutatum y es una de las enfermedades más destructivas de la fresa en todo el mundo. Colletotrichum gloeosporioides se asocia con menos frecuencia con la podredumbre de la fruta antracnosis, pero ocasionalmente produce síntomas indistinguibles de los de C. acutatum en la fruta de fresa. Las especies de Colletotrichum se identifican tradicionalmente por morfología conidial, presencia o ausencia de setae, presencia o ausencia de un estado teleomorfo y color de colonia (Gunnell y Gubler, 1992).
Colletotrichum acutatum produce conidios rectos y cilíndricos (8.5-16.5 x 2.5-4 μm) con extremos atenuados o puntiagudos. Los conidios forman masas de rosa, rosa salmón o naranja y se producen en un acervulo. Las setas (4-6 x 3-3.5 μm) son mucho más cortas que las de otras especies, generalmente aseptadas, y rara vez se producen. C. acutatum no tiene un estado teliomorfo (Peres et al., 2005).
Los conidios de C. gloeosporioides son cilíndricos, redondeados en la base, y miden 14.5-17 x 4-4.5 μm. Esta especie produce 1-3 setas septadas (70-103 x 3.5-4.5) y forma peritecios del estado teliomorfo, G. cingulata. Las colonias de C. gloeosporioides tienen un crecimiento micelial denso y blanco que se vuelve de un color gris oliva oscuro con la edad (Gunnell y Gubler, 1992; Smith, 1998).
Procedimientos de diagnóstico
Tradicionalmente, las características morfológicas como la forma conidial, la presencia o ausencia de setas y el color de la colonia se han utilizado para diferenciar las especies de Colletotrichum. Estos rasgos, sin embargo, son muy variables entre los aislados y a menudo están sujetos a interpretación. Las diferencias morfológicas entre C. acutatum y C. gloeosporioides son demasiado sutiles para una diferenciación confiable cuando se cultivan en Papa-dextrosa-agar (PDA). Para realizar mediciones y observaciones morfológicas de conidios y setas, los aislados deben cultivarse en agar hoja de fresa (SLA) bajo luz fluorescente continua. Una diferencia importante que es útil para determinar las especies de Colletotrichum es la tasa de crecimiento. La tasa de crecimiento de C. acutatum en cultivo es más lenta que otras especies de Colletotrichum a todas las temperaturas, con la mayor diferencia a 32°C. Se pueden realizar análisis de secuencia de ITS para identificar especies de Colletotrichum. Las regiones espaciadoras transcritas internas, incluido el ADNr 5.8, se pueden amplificar utilizando cebadores universales ITS1 e ITS4 (Garrido et al., 2009).
Referencias
Garrido C., Carbú, M., Fernández-Acero, F. J., Vallejo, I., Cantoral, J. M. 2009. Phylogenetic relationships and genome organisation of Colletotrichum acutatum causing anthracnose in strawberry. European Journal of Plant Pathology 125: 397–411. ↲
Gunnell, P. S., and Gubler, W. D. 1992. Taxonomy and morphology of Colletotrichum species pathogenic to strawberry. Mycologia 84:157–165. ↲
Peres, N. A., Timmer, L. W., Adaskaveg, J. E. and Correll, J. C. 2005. Lifestyles of Colletotrichum acutatum. Plant Disease 89: 784–796. ↲
Smith, B. J. 2008. Epidemiology and Pathology of Strawberry Anthracnose: A North American Perspective. HortScience 43:69-73. ↲
Smith, B. J. 1998. Anthracnose Fruit Rot (Black Spot). Pp. 31-33 in: Compendium of Strawberry Diseases, 2nd edition, Maas, J. L. (ed.). APS Press. St. Paul, MN. ↲
Publication date: Jan. 5, 2024
There is an alternate English language version of this document here: Anthracnose Fruit Rot of Strawberry
N.C. Cooperative Extension prohibits discrimination and harassment regardless of age, color, disability, family and marital status, gender identity, national origin, political beliefs, race, religion, sex (including pregnancy), sexual orientation and veteran status.